Vitamine & Vitalstoffe
Ohne Magnesium kein Vitamin D
Die Formulierung des Titels ist inhaltlich nicht ganz korrekt, soll jedoch den Umstand beschreiben, dass die wichtigsten Schritte des Vitamin D Stoffwechsels wie Transport, Aktivierung und Regulation von Magnesium abhängig sind. In der Abbildung 1 sieht man ganz deutlich, dass (nahezu) jeder Schritt Magnesium benötigt. Nahezu steht in Klammern, weil die einzige vom Magnesium unabhängige Reaktion die Bindung des Vitamin D an sogenannte Nicht-VDBP-Transportmoleküle ist, wie Albumin und verschieden Lipoproteine. Das betrifft jedoch lediglich 10-15 % des gesamten Vitamin D1. Wenn in diesem Artikel von Magnesium gesprochen wird, dann ist die Rede von Magnesiumionen, korrekte Bezeichnung Mg2+, Bestandteil von Salzen wie zum Beispiel Tri-Magnesium-Di-Citrat oder Magnesiumchlorid.
Eine Gruppe amerikanischer Wissenschaftler der Vanderbilt University hat die Zusammenhänge zwischen dem Gehalt an Magnesium und Vitamin D untersucht. Die Grundlage bildeten die Daten einer gross angelegten Untersuchung namens „National Health and Nutrition Examination Survey (NHANES)“. Dahinter verbirgt sich eine Reihe an Studien, die ihren Anfang in den frühen 1960er des letzten Jahrhunderts genommen haben. Die statistische Auswertung der gewonnen Daten durch das National Center for Health Statistics (NCHS) hat interessante Details über den Zusammenhang zwischen dem Vitamin-D-Status und Magnesium zu Tage gebracht. So gab es eine Korrelation zwischen einer hohen Magnesiumaufnahme (durch die Nahrung oder Nahrungsergänzungsmittel) und einer signifikant reduzierten Gefahr eines Vitamin-D-Mangels bzw. einer Unterversorgung. Mit anderen Worten: Je mehr Magnesium man aufnimmt, umso mehr 25(OH)D ist im Serum auffindbar. Darüber hinaus konnte die schützende Wirkung der höheren Serumkonzentrationen von 25(OH)D in Bezug auf die allgemeine Sterblichkeit, Sterblichkeit durch kardiovaskuläre Erkrankungen oder Darmkrebs nur in den Gruppen beobachtet werden, deren Magnesiumaufnahme über dem Durchschnitt (d.h. ≥ 264 mg/Tag) lag.
Das sind die beiden wichtigen Kernbotschaften dieser Untersuchungen: Es gibt einen statistisch relevanten Zusammenhang zwischen dem Gehalt an Magnesium und dem Gehalt und der Wirksamkeit von Vitamin D in Bezug auf die Sterblichkeit.
Wissenschaftlich betrachtet liegt kein Beweis vor, dass das Magnesium für die Wirksamkeit von Vitamin D notwendig ist, lediglich ein statistisch relevanter Zusammenhang konnte nachgewiesen werden. Betrachtet man die einzelnen Schritte des Vitamin D-Stoffwechsels (siehe folgenden Abschnitt), erscheint es mehr als nur naheliegend, dass Magnesium tatsächlich für die Aktivität von Vitamin D benötigt wird. Es gibt außerdem weitere Indizien, die auf eine „Zusammenarbeit“ beider Stoffe hindeuten. Es ist bekannt, dass Vitamin D unter anderem vor Diabetes, Herzkreislaufkrankheiten und Schlaganfall schützen kann. Interessanterweise werden niedrige Magnesiumspiegel mit denselben Krankheiten in Verbindung gebracht2-5.
Ein kurzer Exkurs in den Vitamin-D-Stoffwechsel (Abbildung 1): Das Vitamin D, auch als Cholecalciferol bezeichnet, ist streng genommen kein Vitamin, denn es kann vom Organismus selbst hergestellt werden. Somit wäre es basierend auf seiner Struktur und Funktion korrekt als Prohormon zu bezeichnen. Unter natürlichen Bedienungen ist die Hauptquelle für Vitamin D die Haut, wo es mithilfe des Sonnenlichts aus 7-Dehydrocholesterol synthetisiert wird. Bei der modernen Lebens weise, die durch lange Aufenthalte hinter UVB-dichter Verglasung in Gebäuden oder Fahrzeugen gekennzeichnet ist, rückt die alternative Versorgung über die Ernährung weiter in den Vordergrund. Der Transport des Cholecalciferols durch den Körper (im Blut) findet gebunden an unterschiedliche Proteine statt, hauptsächlich (85-90 %) an Vitamin-D-bindende Proteine (DBP, engl. VDBP). Das erstmals lose gebundene Vitamin D hat eine Halbwertszeit von ca. einem Tag und wird anschließend in die Leber transportiert, wo es hydroxyliert wird. Das so entstandene 25(OH)D (Calcidiol) ist die Hautspeicherform von Vitamin D. Diese Form bindet stärker an das DBP und hat eine Halbwertszeit von rund 3 Wochen6. Um seine Aktivität zu entfalten, muss das Calcidiol weiter modifiziert werden. Dieser Vorgang findet hauptsächlich, aber nicht ausschliesslich, in der Niere statt. Die Aktivierung erfolgt durch eine weite Hydroxylierung im Zytoplasma zu 1,25(OH)D (Calcitriol). Das beteiligte Enzym 1-α-Hydroxylase wird seinerseits durch das Parathormon (PTH) aktiviert. Es ist eine weitere Reaktion möglich. Durch die Hydroxylierung an der Position 24 wird das Vitamin D inaktiviert. Anhand der roten Kreise kann man recht einfach verfolgen, dass bei allen Reaktionen in diesem Netzwerk (Bindung an DBP, Hydroxylierung durch die 25 Hydroxylase, die 1-α-Hydroxylase oder die 24-Hydroxylase und die PTH-Aktivierung) Magnesium als Kofaktor beteiligt ist. Im Umkehrschluss bedeutet das, dass ohne Magnesium diese Reaktionen nicht im ausreichenden Mass ablaufen können.
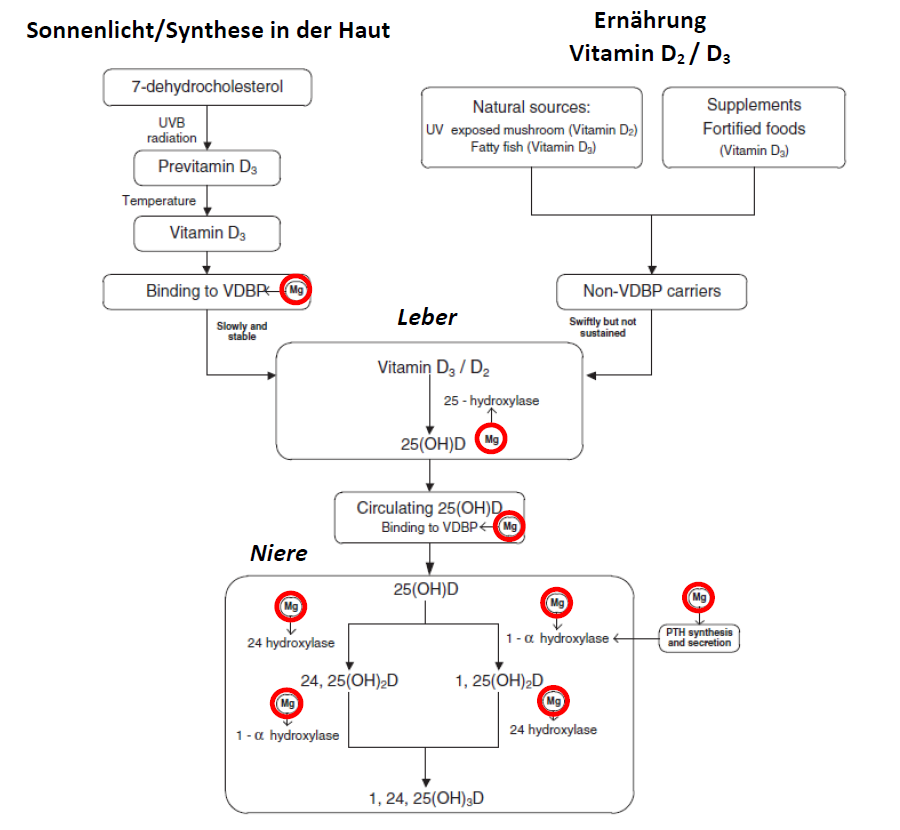
Abbildung 1: Magnesium und Vitamin D-Stoffwechsel. PTH: Parathormone; VDBP: Vitamin D Binding Protein; rote Kreise: Mg2+ (verändert nach 7).
Es ergibt sich aus den vorgenannten Betrachtungen ein eindeutiges Ergebnis: Die Wirksamkeit von Vitamin D ist ohne Magnesium stark eingeschränkt, und eine Kontrolle des Magnesiumspiegels ist auf jeden Fall sinnvoll. Auf der anderen Seite „bedankt“ sich das Vitamin D, denn es verbessert die Aufnahme von Magnesium aus dem Darm, da es die Expression des Calcium-bindenden Proteins aktiviert, das auch eine geringe Affinität für Magnesium hat. Dieses zweithäufigste Mineral unserer Zellen ist ausserdem an mehreren Hundert Reaktionen beteiligt. Die Zahlen variieren zwischen 300 und 800 Enzyme, die Magnesium als Kofaktor benötigen. Dank der modernen industriellen Landwirtschaft, die künstliche Dünger einsetzt, verarmen die Böden zunehmend an Mineralien, einschließlich Magnesium8-11. Dadurch enthalten die Früchte und Gemüse natürlicherweise auch weniger Mineralien und Vitamine. Der Mensch steht am Ende dieser Nahrungskette und ist dementsprechend minderversorgt.
Ein weiterer Grund ist der Umstand, dass die modernen landwirtschaftlichen Erzeugnisse durch klassische Kreuzungen (in Zukunft immer mehr durch Gentechnologie) dahingehend gezüchtet wurden, dass sie möglichst resistent gegen die konventionelle Pflanzenschutzmittel sind und sich gut transportieren und lagern lassen. Den Gehalt an bioaktiven Substanzen wie Mineralien, Vitamine und sekundäre Pflanzenstoffe hat man dabei meist nicht beachtet. Das Ernten von unreifen Früchten wirkt sich ebenso negativ auf die Inhaltsstoffe aus. Das reife Aussehen lässt sich zwar künstlich durch Hormone erzielen, eine Zunahme der Inhaltsstoffe ist nach dem Abtrennen von der Pflanze naturgemäß nicht mehr möglich.
Was also tun?! Eine zusätzliche Einnahme in Form von Kapseln oder Pulver (meist günstigere Variante) ist durchaus akzeptabel. Am besten verteilt man die Tagesdosis auf zwei Portionen, eine abends und eine morgens, weil die Niere sofort mit der Ausscheidung des Salzes beginnt, sobald es ins Blut gelangt. Die empfohlene Konzentration liegt bei 0,8-1,1 mmol/l. Durch welche Menge sie erreicht werden kann, hängt von der individuellen Ernährung, dem Körpergewicht und weiteren Faktoren ab. Bei einem Körpergewicht von 70 kg wird man kaum weniger als 400 mg Magnesium täglich benötigen. Zur Auswahl stehen mehrere Salze, wobei sich organisch gebundene Verbindungen wie Aspartat, Citrat oder Gluconat anbieten, da dies natürlich vorkommende Verbindungen sind. Eine Ausnahme betrifft das MgCl - Magnesiumchlorid. Es eignet sich sehr gut für die transdermale Magnesiumtherapie, allerdingst erst bei einer Konzentration von ca. 30 %.
Reference List
1. Vieth, R. Simple method for determining specific binding capacity of vitamin D-binding protein and its use to calculate the concentration of "free" 1,25-dihydroxyvitamin D. Clin. Chem. 40, 435-441 (1994).
2. Zhang, W., Iso, H., Ohira, T., Date, C. & Tamakoshi, A. Associations of dietary magnesium intake with mortality from cardiovascular disease: the JACC study. Atherosclerosis 221, 587-595 (2012).
3. Xu, J. et al. Associations of serum and urinary magnesium with the pre-diabetes, diabetes and diabetic complications in the Chinese Northeast population. PLoS. One. 8, e56750 (2013).
4. Song, Y. et al. Dietary magnesium intake and risk of cardiovascular disease among women. Am. J. Cardiol. 96, 1135-1141 (2005).
5. Larsson, S. C., Orsini, N. & Wolk, A. Dietary magnesium intake and risk of stroke: a meta-analysis of prospective studies. Am. J. Clin. Nutr. 95, 362-366 (2012).
6. Haddad, J. G., Matsuoka, L. Y., Hollis, B. W., Hu, Y. Z. & Wortsman, J. Human plasma transport of vitamin D after its endogenous synthesis. J. Clin. Invest 91, 2552-2555 (1993).
7. Deng, X. et al. Magnesium, vitamin D status and mortality: results from US National Health and Nutrition Examination Survey (NHANES) 2001 to 2006 and NHANES III. BMC. Med. 11, 187 (2013).
8. Thomas, D. A study on the mineral depletion of the foods available to us as a nation over the period 1940 to 1991. Nutr. Health 17, 85-115 (2003).
9. Thomas, D. The mineral depletion of foods available to us as a nation (1940-2002)--a review of the 6th Edition of McCance and Widdowson. Nutr. Health 19, 21-55 (2007).
10. Davis, D. R., Epp, M. D. & Riordan, H. D. Changes in USDA food composition data for 43 garden crops, 1950 to 1999. J. Am. Coll. Nutr. 23, 669-682 (2004).
11. Mayer, A.-M. Historical changes in the mineral content of fruits and vegetables. (99/6), 207-211. 1997. British Food Journal.
Ref Type: Generic
